
電話:
021-67610176傳真:
1. Cell:揭示腸道微生物組與自身免疫疾病存在關聯
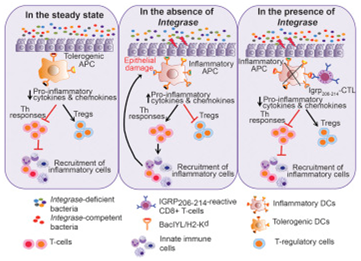
很多人把“細菌”這個單詞與骯臟和惡心的東西關聯在一起。加拿大卡爾加里大學卡明醫學院的Pere Santamaria博士并不同意這一點。Santamaria說,我們體內的細菌,即微生物組,對我們的健康產生各種積極的影響。“我們腸道中的細菌實際上具有很多有益的功能。它們有助我們消化,阻止病原體感染和訓練我們的免疫系統如何加以應對。”
如今,在一項新的研究中,Santamaria和卡明醫學院的Kathy McCoy博士及其團隊揭示出腸道微生物組中的一種調節促炎性細胞和抗炎性細胞的新機制。McCoy說,“我們發現由被稱作擬桿菌(Bacteroides)的腸道細菌表達的一種蛋白快速地招募白細胞來殺死一種導致炎癥性腸病(inflammatory bowel disease, IBD)的免疫系統細胞,從而阻止IBD發生。我們認為這種機制可能有助阻止大多數人患上IBD。”
然而,這種被稱作整合酶(integrase)的蛋白招募白細胞的方法有一個缺點。Santamaria說,“在一些人中,這些白細胞對導致IBD的細菌的存在作出過度反應。導致IBD等問題的原因不是這些細菌本身,而是這種蛋白觸發免疫系統產生的嚴重反應。這些相同的過度活化的白細胞也是導致糖尿病等其他的自身免疫疾病的細胞。這一發現證實了腸道微生物組對免疫系統的影響,并發現了腸道微生物組變化能夠增加自身免疫疾病風險的新機制。盡管我們專門研究IBD,但是腸道中的多種蛋白可能通過類似的機制促進其他的自身免疫疾病產生。”
對腸道微生物組的研究需要分離動物模型中的單個細菌以便排除其他的環境因素。McCoy說,“正是在無菌小鼠中開始我們的研究合作。”在加入卡爾加里大學之前,McCoy一直在瑞士伯爾尼大學研究無菌小鼠。“Santamaria博士將他的小鼠品種送給了我,讓它們保持無菌,隨后我們能夠添加回在腸道中表達或不表達這種蛋白的單個細菌物種來研究由此產生的影響。”六年后,Santamaria和McCoy仍然在一起合作,并展望他們的發現的未來影響。
雖然有必要開展更多的研究,但是Santamaria和McCoy樂觀地認為利用腸道微生物組力量的新療法將會被開發出來。2017年11月在卡爾加里大學卡明醫學院新開設的加拿大西部微生物組中心(Western Canadian Microbiome Center)無菌設施將為研究腸道細菌提供的空間。McCoy說,“我們將能夠研究特定的腸道微生物組,而無需考慮其他的環境變量。這將有助我們推動這項研究和完成很多關于腸道微生物組影響的其他研究。”
相關研究結果發表在2017年10月19日的Cell期刊上,論文標題為“A Gut Microbial Mimic that Hijacks Diabetogenic Autoreactivity to Suppress Colitis”。
2. PNAS:治療自身免疫紊亂新機制
zui近,來自德國的研究者們的一項新發現加深了我們隊自體免疫疾病機制的認知。他們證實了程序性的細胞死亡、補體系統激活以及患者系統性炎癥反應引發的器官損傷之間的。相關結果發表在zui近一期的《PNAS》雜志上。
抗中性粒細胞胞漿抗體(ANCA)伴隨性血管炎的主要癥狀是機體免疫系統攻擊白血球,導致小血管炎癥反應的產生。血管炎往往會導致腎臟功能衰竭,同時也會影響肺臟以及其它器官的功能。常規的治療手段是基于對免疫系統的壓制發揮作用,這種方法或許能夠阻斷疾病的惡化,但也具有十分明顯的副作用。
因此,該疾病的發生原因究竟如何呢?zui近,由Adrian Schreiber博士領導的研究組發現這一疾病的發生是由于機體白細胞的程序性死亡(細胞壞死性凋亡,necroptosis)導致的。
靶向自身蛋白的的抗體能夠特異性地識別白細胞表明的某些抗原分子,進而激活壞死性凋亡以及NET的形成。NET即neutrophil extracellular traps,指的是由DNA組成的胞外復雜網狀結構。研究者們發現這些結構對于補體系統的激活具有重要的作用,進而導致疾病的發生。利用一系列遺傳修飾動物模型以及藥理學模型,研究者們發現壞死性凋亡是嚴重血管炎發生的關鍵環節之一,同時也會導致腎臟功能的紊亂。
“通過藥物處理特異性地抑制程序性細胞凋亡后續可以成為治療ANCA的新方法”,Schreiber博士說道:“目前的*臨床試驗正在進行中,我們對此拭目以待”。
3. Heart:自身免疫疾病會增加心血管事件和死亡風險!
來自德爾馬醫學研究所醫院(IMIM)和IDIAP Jordi Gol的研究人員剛剛發表了一篇文章。該文章顯示,自身免疫性疾病會顯著地增加心血管以和總體死亡率。這在患有類風濕關節炎或系統性紅斑狼瘡的人群中尤為明顯。此外,該研究也看到諸如克羅恩病或潰瘍性結腸炎等炎性腸病也會增加中風和死亡的風險。該文章發表在本月的Heart期刊上。
這項研究為期6年,分析了近100萬名年齡在35至85歲之間的無心血管病史人群。如此大的樣本足以估計被診斷患有自身免疫病人群的心血管事件發生率和死亡率。其中一些疾病相對普遍,因此它們的影響非常顯著。據估計,在西班牙有15萬至20萬人患有類風濕性關節炎,10萬人患有克羅恩病和潰瘍性結腸炎。
"我們想確定冠心病、卒中或總體死亡的風險在身患克羅恩氏病和潰瘍性結腸炎、類風濕性關節炎、系統性紅斑狼瘡或強直性脊椎炎等自身免疫病的病人中是否有增加,并確定發病的病理學機制。" IMIM心血管病流行病學研究組研究人員、也是該文章的主要作者MaríaGrau解釋說。
研究結果表明,諸如狼瘡、類風濕性關節炎等結締組織的系統性失調與更大的心血管風險和總體風險率有關。其次是克羅恩病和潰瘍性結腸炎等炎性腸病,這些病的卒中和死亡風險會增加。雖然過去的研究已經表明了慢性自身免疫炎性疾病和心血管風險之間的關系,但本文的大樣本和研究設計使該結果具有更廣泛的意義。
"我們相信,類風濕性關節炎和狼瘡所增加的心血管問題風險和死亡風險是因為炎癥、代謝因素、治療和疾病相關因素的相互作用," MaríaGrau解釋說,"因此,開發新工具-即自身免疫炎性疾病活動的生物標志物-來預測心血管事件,可幫助減少這些事件的發生。"
預防是關鍵
心血管疾病的一級預防是公共衛生議程的關鍵優先事項,因為心血管疾病是發達國家的主要致死因素,且在發展中國家的發病率不斷增長。心血管疾病的共同基礎是動脈粥樣硬化-一種在一個人的一輩子中所表現的炎性退行過程。
自身免疫病會在zui有活力的人生階段影響人們,且殺傷力非常大。早期檢測很關鍵,因為在疾病初期有一個階段是能避免對其他器官的*性損傷的。更好地理解這些情況與心血管疾病發病的關系可幫助在早期進行風險因子的評估的管理,從而改善這些病人的長期結果。
4. Cell:重磅!揭示自身免疫疾病中表位擴散之謎
一項花費了4年取得的新發現有潛力改變我們看待自身免疫疾病和理解免疫細胞如何和為何開始攻擊體內不同組織的方式。
美國哈佛醫學院波士頓兒童醫院的Michael Carroll博士說,“一旦人體對它自己的組織的耐受性喪失,發生的一連串反應就像一輛失控的火車。對人體自身的蛋白或者抗原作出的免疫反應看起來*類似于人體對外源病原體作出的反應。”
Carroll團隊多年來一直在研究狼瘡模式小鼠,以便更好地理解自身免疫疾病的復雜細節。他們的發現揭示出缺乏控制的B細胞---能夠產生抗體并且對免疫系統進行編程來攻擊某些抗原的免疫細胞---能夠觸發身體發起自身免疫攻擊。除此之外,B細胞的免疫靶向指令還能夠快速地擴展,從而對體內的更多組織發起攻擊。相關研究結果發表在2017年8月24日的Cell期刊上,論文標題為“Clonal Evolution of Autoreactive Germinal Centers”。
Carroll和他的團隊認為他們的發現zui終能夠揭示一種被稱作表位擴散(epitope spreading)的生物學現象。表位擴散指的是當免疫系統開始攻擊體內其他部位表面上的之前未被要求摧毀的抗原。
表位擴散是自身免疫疾病的一種特征,這是因為它導致對體內自身的組織發起廣泛的免疫攻擊,而理解是什么觸發它可能為開發旨在阻止自身免疫反應的新療法打開大門。
論文*作者Søren Degn博士說,“長期以來的臨床觀察結果是自身免疫疾病隨著時間的推移發生進化,對不斷擴大的器官和組織發起攻擊,這種現象就被稱為‘表位擴展’。”在患者中,這意味著臨床癥狀的擴大,包括關節疼痛、腎臟損傷和嚴重的皮疹。但是在此之前,我們對這種過程如何發生在很大程度上仍是未知的。
多彩的免疫系統
為了理解是什么導致表位擴散,Carroll團隊在一種通常被稱作狼瘡的自身免疫疾病模式小鼠中采用了一種被稱作“五彩紙屑(confetti)”的技術。
Degn說,“狼瘡被譽為‘偉大的模仿者’,這是因為這種疾病能夠具有如此多不同的類似于其他常見疾病的臨床表現。它是一種多器官疾病,具有多種潛在的抗原靶標和受影響的組織,并且涉及多種‘免疫參與者’。狼瘡被認為是一種原始的自身免疫疾病,這就是研究它是如此有趣的原因。”
通過研究小鼠,Carroll團隊利用熒光“標記”蛋白區分不同的B細胞,正如人體中那樣,這些B細胞是協助發起免疫反應的細胞。當身體識別一種抗原(外源的蛋白,或者在自身免疫疾病中,將自身的抗原視作為外源的)時,B細胞聚集在被稱作生發中心(germinal center)的細胞簇中。
論文共同作者、Carroll實驗室博士后研究員Cees van der Poel博士說,“這就是在感冒或喉嚨痛發生時,淋巴結發生腫脹的原因。這些生發中心填充在淋巴結中,準備發起免疫反擊。脾臟是生發中心形成的另一個部位。”
在這些生發中心內,作為對被檢測到的抗原作出的反應,B細胞產生競爭性的抗體,這些抗體相互競爭以便產生的抗體來完成中和這種入侵的威脅的任務。zui終,這些的攜帶著zui為有效抗體的B細胞克隆觸發免疫攻擊。然而,如果身體不正確地識別到它自己的組織表面上的一種“自身抗原”,那么這種高度有效的過程能夠造成嚴重破壞。
通過利用熒光顏色區分B細胞克隆,Carroll團隊觀察到相同的生發中心活性在自身免疫反應期間發生。在狼瘡模型中,這些B細胞“顏色”努力產生自身抗體。
van der Poel說,“這真地是微觀世界中的自然選擇。一旦被激活,存在10種不同的顏色來代表不同的B細胞克隆。在一到兩個星期內,這種顏色多樣性開始發生轉變---zui終一種顏色占據主導地位,這代表著單個B細胞克隆勝出。”
阻斷自身免疫疾病
Carroll說,一旦觸發自身免疫反應,“這就好比是一輛失控列車離開車站”,而且免疫系統開始攻擊體內其他地方存在的其他的相類似的自身抗原。
Degn說,“隨著時間的推移,初始時產生‘勝出的’自身抗體的B細胞開始招募其他的B細胞來產生附加的破壞性的自身抗體---正如一塊鵝卵石被扔進水中,漣漪就會擴散開來。”
Carroll說,“這一發現是令人吃驚的。它不僅告訴我們自身反應性B細胞不僅在生發中心內競爭來產生自身抗體,而且我們也觀察到這種免疫反應發生擴散而攻擊體內的其他組織,從而快速地導致表位擴散。”
如今,鑒于這種模式小鼠允許這些研究人員觀察到自我耐受性喪失和自身反應性的表位擴散,他們將進一步研究炎癥、免疫系統導致的天然的細胞死亡/移除和細胞核內的抗原之間的復雜相互作用如何加劇B細胞產生自身抗體。
Carroll說,就目前而言,理解生發中心內的B細胞活性如何與表位擴散存在關聯是向正確的方向邁進了一大步。他們猜測一種“阻斷”生發中心的療法(作用于免疫系統的工作記憶)可能有朝一日被用來阻止自身免疫疾病的惡性循環。
Carroll說,“在自身免疫反應期間,阻斷生發中心可能潛在地阻斷這種表位擴散過程。如果能夠短暫地阻止這種適應性免疫系統,那么它可能允許身體重置它的免疫反應和關閉自身免疫。”
5. PNAS:深入解讀調節性T細胞的功能有望幫助開發癌癥和自身免疫疾病的新型療法
調節性T細胞(Tregs)是機體免疫系統的交通jingcha,其能夠有效指導其它免疫細胞何時出動以及何時停止行動,闡明如何指揮調節性T細胞的活性對于改善癌癥免疫療法以及開發治療自身免疫疾病的新型療法具有重要的意義,比如風濕性關節炎和1型糖尿病。
近日,一項刊登在雜志Proceedings of the National Academy of Sciences上的研究報告中,來自索爾克研究所的研究人員通過研究發現了一種特殊蛋白質能夠控制調節性T細胞的存活和功能,相關研究或能幫助研究人員開發多種方法來影響調節性T細胞的功能,zui終使得和免疫相關的療法變得更加有效。
研究者Ronald Evans表示,調節性T細胞常常處于炎癥的十字路口,如果在環境中機體中含有過多的調節性T細胞,那么氣就會削弱免疫反應,而如果機體中調節性T細胞的數量過少,機體就會患上慢性炎癥。目前并沒有良好的靶點能幫助控制調節性T細胞,而這項研究卻非常重要,因為其能夠幫助研究者闡明細胞代謝在這些免疫細胞功能發揮上所扮演的關鍵角色。
研究者所發現的蛋白質名為Lkb1(肝臟激酶B1),激酶是一類能夠催化細胞內反應的酶類,此前研究者認為,Lkb1在細胞代謝過程中扮演著關鍵角色,但這項研究中,研究者并不清楚Lkb1是否能夠控制調節性T細胞在免疫反應中的功能。研究者Annette Atkins說道,當我們談論到代謝時,大部分人都會考慮到一些因素,比如我們所吃的東西,鍛煉的程度等,但這項研究中我們觀察了單一細胞的代謝情況,通過中和細胞制造能量的能力,研究者就能夠看到非常嚴重的自身免疫疾病。
當前研究中,研究者利用機體調節性T細胞中Lkb1基因被敲除的小鼠模型進行研究,小鼠會表現出多種自身免疫疾病癥狀,同時會在出生后不久死亡。后期深入研究結果表明,小鼠機體中調節性T細胞的正常代謝功能被打斷了,而且這些細胞中含有功能缺陷的線粒體,從而產生ATP的水平就會被明顯減弱。
研究者認為,Lkb1通路對于向調節性T細胞提供能量非常重要,一旦缺失該通路,調節性的T細胞就無法制造足夠的能量來保持功能。而且調節性T細胞還需要能量來完成自己的工作,來抑制其它種類的T細胞攻擊機體,這是研究者此前并未發現的一種特殊機制。
這項研究對于后期研究人員開發新型癌癥免疫療法及自身免疫疾病療法具有重要的意義。在癌癥中,調節性T細胞會被腫瘤招募來抑制其它類型T細胞發揮功能,包括殺傷性T細胞等,為了增強癌癥免疫療法的效果,研究人員就需要發現能夠阻斷Lkb1途徑的方法,而這種抑制作用所產生的后果就是增強了機體抵御其它類型T細胞的免疫反應,從而就能夠幫助有效破壞腫瘤。
從另外一方面來講,增強調節性T細胞的能力來抑制其它免疫細胞發揮功能還能夠抑制自身免疫反應,而這是通過抑制這些細胞攻擊機體器官和組織來實現的;增強調節性T細胞的數量還能夠在患者qiguanyizhi后轉移機體的免疫排斥反應。研究者表示,盡管Lkb1本身很難被靶向作用,但這項研究中我們在該信號通路下游鑒別出了能被藥物修飾改變的關鍵分子,這些藥物要么會抑制要么就會增強該通路的活性,后期研究人員還需要更多深入的研究來開發出有效治療癌癥和自身免疫疾病的新型藥物。
6. Nat Immunol:病毒感染可以治療自體免疫疾病

抗體是抵抗病毒或細菌入侵機體的關鍵武器,它通過中和病原體的方式發揮作用。然而,隨著機體在針對感染產生更加有效的抗體的同時,也會產生結合能力更加強的自體免疫性抗體分子,從而引發類風濕性關節炎、系統性紅斑狼瘡以及多發性硬化等等。
zui近,來自阿拉巴馬大學伯明翰分校醫學院的助理教授André Ballesteros-Tato等人則針對這一問題進行了深入了研究。在發表在《nature immunology》雜志上的一篇文章中,Ballesteros-Tato等人利用小鼠模型研究了免疫系統抑制自體免疫疾病的調節機制。通過給小鼠接種流感病毒,作者發現小鼠免疫反應的后期會產生一種特異性的免疫細胞,即T濾泡調節性細胞(TFR)。這些細胞能夠抑制自體免疫抗體的產生,但同時不會對抗病毒免疫反應有任何影響。
“這項研究揭示了自體免疫疾病發作的機制”,Ballesteros-Tato說道。
濾泡調節性T細胞相比調節性T細胞(Treg)是此前了解較少的細胞類群。UAB的研究者們發現這兩類細胞在病毒感染過程中的作用并不相同。*,IL-2在免疫反應發生時會有顯著的升高,并且能夠刺激常規Treg的增殖。在小鼠實驗中,作者發現這類細胞的數量在感染一星期之后達到了。然而,作者發現IL-2信號則會抑制TFR的表達,其中Blimp1起著關鍵的作用:Blimp1能夠抑制Bcl-6的轉錄活性,進而抑制TFR的表達。
當流感病毒數量得到控制以及IL-2的水平降低之后,一些Treg細胞表面CD25(IL-2的受體)的表達量開始下降,這些細胞Bcl-6的轉錄活性升高,進而向TFR方向分化,并且在感染30天之后達到了。TFR細胞能夠遷移至淋巴結的濾泡中,幫助B細胞基因重排產生更加強的抗體。
在濾泡中,TFR細胞能夠抑制自體反應性B細胞的增殖,但不會影響機體抵抗流感病毒的免疫反應。通過實驗手段敲除TFR細胞或抑制其發育能夠導致B細胞的擴增以及自體反應性抗體的產生。
“總之,我們的數據表明IL-2信號能夠暫時性地抑制TFR細胞的反應,但是一旦免疫反應得到了解決,TFR細胞則會發生分化以及遷移至濾泡中,進而維持B細胞的耐受性。”研究者們這樣說道。
7. Nature:“基因剪刀”—CRISPR-Cas9變“鈍“為自體免疫病研究提供新啟示
http://news.bioon.com/article/6709195.html
我們機體細胞中含有22000個基因,但對于每個細胞來說,其常用的基因組合往往各不相同。這種基因表達與抑制的特征zui終影響了細胞類型的形成,例如腎臟、大腦、皮膚、心臟等等。
為了調控這種基因表達的特征,基因組中存在很多調控元件,它們受外界信號的影響對基因的表達“開閉”進行地調控。其中有一類叫“增強子”的元件,這段序列與基因編碼區相隔幾萬個堿基對,但仍具有增強基因表達的能力。基因表達調控的紊亂會導致很多疾病的發生,但由于它們的功能存在嚴格的時空特性,即僅僅在特定的條件下、特定的細胞中會發揮作用,因此往往難以研究。
如今,來自加利福尼亞大學的研究者們利用修飾后的CRISPR系統尋找增強子,這一更新后的工具并不具有基因編輯能力,相反地,它能夠地定位增強子存在的區域。根據zui近發表在《nature》雜志上的相關結果,來自UCSF的研究者們利用這種叫做CRISPR activation (CRISPRa)的工具成功地找到了調控免疫細胞發育的增強子。這段序列對于自體免疫疾病的發生具有重要的作用。
CRISPR技術能夠使得研究者們快速地理解表達蛋白質的基因的功能。zui常用的一項應用就是將其與CAS9酶聯合使用,對特定的DNA序列進行剪切。利用這一技術,研究者們能夠快速且地對任何基因進行編輯,從而觀察這些改變對細胞或機體功能的影響。
然而基因占據基因組的比例不足2%,而剩余包括增強子在內的98%的序列難以研究。研究者們能夠尋找通過蛋白質與DNA的結合特征尋找潛在的增強子區域,但關于增強子與基因的相互作用則十分困難。此外,由于增強子活性存在嚴格的時空特性,因此僅僅通過CRISPR-CAS9技術切除增強子區域并不會起到多大幫助。
而來自USCF的Jonathan Weissman教授等人開發出的這種叫做“CRISPRa”的技術則能夠對增強子進行地激活。與傳統的CRISPR-CAS9技術不同,CRISPRa利用修飾后的Cas9酶與CRISPR聯合使用,能夠在找到特定DNA序列之后進行靶向激活,而非切割。該技術zui早是應用于尋找啟動子區域,而這一次研究者們則試圖尋找增強子區域。
具體地,研究者們研究的是一種編碼“IL2RA”的蛋白的基因。該蛋白對于T細胞的功能具有重要的作用。IL-2RA能夠決定T細胞啟動炎癥反應或進行免疫抑制。如果該基因的增強子區域出現故障,那么細胞將難以起到抑制炎癥反應的能力,從而導致自體免疫疾病的發生。
通過對IL2RA上游的DNA序列進行連續篩選,作者發現一段序列對于調控IL2RA的產生具有重要的作用,并zui終證明其為IL2RA基因的增強子。
研究者們希望下一步對這一技術進行擴展,或許能夠同時對更多的基因進行增強子篩選。此外,他們還希望這一方法能夠用于研究所有類型細胞的遺傳互作情況。
8. PNAS:組織相容性復合體通過調節腸道微生物穩態保護機體不受I型糖尿病與其它自體免疫性疾病的影響

zui近一項研究發現,一種保護機體抵抗自體免疫疾病,尤其是I型糖尿病的基因是通過改變腸道微生物的組成發揮功能的。小鼠水平的試驗結果表明,發育關鍵時期如果體內的腸道微生物組受到抗生素的破壞之后,該基因保護機體免受I型糖尿病的作用會受到明顯的影響。這一發現再次強調了嬰幼兒應盡量避免接觸抗生素的重要性。
控制機體免疫系統的平衡是十分復雜的。達到這一目標必須同時保持對外源病原體的敏感性以及對自體分子的耐受性。如果免疫系統錯誤地對自體發起攻擊,則會導致自體免疫疾病的發生。保證免疫系統的特異性的關鍵在于細胞表面的組織相容性復合體(MHC)。長期以來,科學家們已經知道編碼這些蛋白質的基因能夠阻止自體免疫疾病的發生,尤其是I型糖尿病。
然而,這些基因以及蛋白質調節機體的免疫系統的活性的內在機制一直了解的不夠清楚。如今,來自哈佛大學的研究者們發現這些基因中至少有一種是通過調節腸道微生物的穩態發揮其保護功能的。相關結果發表在zui近一期的《PNAS》雜志上。實驗結果表明,盡管擁有這一基因,但小鼠如果在出生之后的一段時間內接受抗生素處理,使其腸道內的微生物結構受到破壞之后,仍然會產生嚴重的胰腺炎(I型糖尿病的前期癥狀)。
這項發現證明腸道微生物是自體免疫疾病以及胰腺功能的重要催化劑。腸道微生物組結構的破壞會導致糖尿病的發生。這一發現為靶向腸道微生物的抗糖尿病免疫療法提供了新的思路。(生物谷Bioon.com)