
電話:
021-67610176傳真:
導讀:基因治療(Gene Therapy)是指將外源基因導入靶細胞,以糾正或補償因基因缺陷或基因表達異常引起的疾病(圖1)。基因治療技術創新和臨床試驗在近幾年如雨后春筍般涌現,多項基因治療項目相繼在美國、歐盟、中國等國家獲得批準上市。基因治療的對象也已經由單基因遺傳病逐步拓展到惡性腫瘤、感染性疾病、心血管疾病、自身免疫性疾病、代謝性疾病等重大疾病。本文簡要回顧近年基因治療的國內外研究進展,與讀者分享。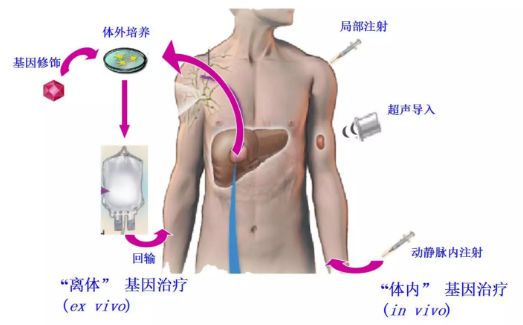
1.發達國家和制藥*加大基因治療研發投入
美國對基因治療領域的資助持續增加。2014年6月,美國國家衛生研究院(NIH)資助2500萬美元,用于傳染性疾病(瘧疾和流感)的基因治療研究。2015年底,美國白宮發布《美國創新新戰略》,明確把包括基因治療在內的醫療作為未來發展戰略,未來10年將投入48億美元重點資助。
歐洲對基因治療領域的資助也持續增加。歐盟研究框架建立了專門基因治療資助計劃——CliniGene(2006-2011)計劃,出資6580萬歐元推動歐洲臨床基因治療的發展。“地平線2020”是歐盟zui大的科研創新框架計劃,其中基因治療獲得4910萬歐元資助。2016年6月,法國政府宣布投資6.7億歐元啟動基因組和個體化醫療項目,項目為期10年,將重點開展基因組學、個體化醫學、基因治療等研究。
此外,跨國的制藥*對基因治療領域投入了大量資金。2014年12月輝瑞(Pfizer)與美國罕見病基因治療公司Spark Therapeutics簽署合作協議,共同開發B型血友病的基因治療產品。2015年4月,百時美施貴寶(BMS)與基因治療領域的——荷蘭的生物技術公司uniQure簽署了一份高達10億美元合作協議,共同開發重組腺相關病毒(AAV)表達載體的心血管基因治療藥物。2016年,百健公司宣布投資20億美元與賓夕法尼亞大學以及REGENEXBIO公司合作開發基于AAV載體的基因治療藥物。
2.基因治療研究開發和產業化已取得重要進展
截止到2017年4月,在Clinical Trial上登記了2463項基因治療臨床試驗方案(圖2),其中進入Ⅱ/Ⅲ期的基因治療臨床試驗方案近500項,共有7個基因治療產品已經在美國、歐盟、中國等國家上市。2012年7月,歐洲藥品管理局(EMA)在歐盟范圍內批準由uniQure公司研發的以AAV為載體的基因治療藥物Glybera上市,用于經嚴格限制高脂肪飲食卻仍然發生嚴重或反復胰腺炎發作的脂蛋白脂酶缺乏癥(LPLD)患者的治療。此外,2014-2015年,Calledon、Spark Therapeutics和Bluebird Bio公司的產品MYDICAR、SPK-RPE65和LentiGlobin獲得FDA批準上市。2016年5月,EMA批準了葛蘭素史克(GSK)的藥物Strimvelis用于治療罕見病腺苷脫氨酶缺陷所致重癥聯合免疫缺陷癥(ADA-SCID),這是*上市的體外基因修飾的造血干細胞基因治療產品。
▲ 圖2-主要國家的基因治療臨床試驗方案分布統計
2017年8至11月,基因治療領域迎來了4個里程碑事件。8月,FDA在批準諾華公司的CAR-T細胞治療產品Kymriah上市,用于治療復發或難治性急性淋巴細胞白血病。10月,FDA的專家小組全票支持批準Spark公司研發的AAV為載體的基因治療藥物AAV-RPE65(Luxturna),用于治療RPE65基因缺陷引起的視網膜疾病,該藥可以阻止患者向*失明發展,有效地改善了患者的光感和視覺;同月,FDA批準了Kite Pharma公司的CAR-T基因治療產品Yescarta上市,用于治療成人復發/難治性大B細胞淋巴瘤;11月,美國Sangamo Therapeutics公司利用鋅指核酸酶(ZFN)技術實現人類歷*患者體內基因組的編輯。
3.基因治療研發的主要發展趨勢
(1)重組腺相關病毒(AAV)載體基因治療。重組AAV源于非致病的野生型腺相關病毒,具有安全性好、宿主細胞范圍廣、免疫源性低、在體內能長時間表達外源基因等特點,是zui有前途的基因治療載體之一。2017年11月,《新英格蘭醫學雜志》發表了一項臨床試驗結果:重組AAV基因治療成功延長了15名身患嚴重遺傳性疾病-1型脊髓性肌萎縮癥(SMA1)患兒的生命,讓他們有機會重獲健康。此外,還有多種以AAV為載體的基因治療藥物正在開展II期或III期臨床試驗,其治療對象幾乎都是單基因遺傳的罕見病,包括血友病A型和B型、地中海貧血、脊髓性肌萎縮癥(SMA)等。
(2)慢病毒載體(LV)基因治療。LV主要用于體外轉基因研究。LV具有可感染非分裂細胞、轉移基因片段容量較大、目的基因表達時間長、不易誘發宿主免疫反應等優點,是應用前景比較良好的病毒載體。Strimvelis、Kymriah和Yescarta等基因治療藥物所用的載體都是LV。
(3)基因修飾的溶瘤病毒基因治療。攜帶治療基因的溶瘤皰疹病毒、溶瘤腺病毒、新城疫病毒等治療惡性腫瘤發展前景良好。近年來,跨國藥企紛紛布局溶瘤病毒項目。安進、輝瑞、阿斯利康等跨國藥企都參與了溶瘤病毒項目。如2011年,安進公司以10億美元收購了專業的基因治療公司BioVex公司(主打產品為GM-CSF修飾的皰疹病毒OncoVEXGMCSF);2015年10月,FDA批準該產品上市,用于治療黑色素瘤。
(4)CRISPR/Cas9等基因編輯技術用于基因治療。近年來,基因編輯技術迅猛發展,正在革命性地改變整個生物技術領域。與傳統基因治療方法相比,基因編輯技術能在基因組水平上對DNA序列進行改造,從而修復遺傳缺陷或者改變細胞功能,使得*治愈白血病、艾滋病和血友病等惡性疾病成為可能。基于鋅指核酸酶(ZFN)基因編輯技術的兩種抗艾滋病和一種B型血友病產品已經進入臨床階段。CRISPR/Cas9基因編輯技術對特定基因組DNA的定位更加,成本更加低廉,正在成為基礎研究和臨床應用的主流技術(圖3)。zui近,美國、英國、日本政府都放開了對基因修飾人胚胎的限制,開展了一系列基因編輯技術修飾胚胎,從而對先天性遺傳病進行基因治療的研究。
▲ 圖3-使用基因剪刀(CRISPR)修改基因組DNA
4.國內科技發展現狀
我國政府對基因治療等相關的基礎研究、目標產品及關鍵技術的研發非常重視,“十一五”和“十二五”期間,863計劃對重大疾病的基因治療專門立項,參加單位包括二十多家國內從事生物治療研究的優勢單位,10余家國家重點實驗室和多家專業的公司,儲備了一批具有自主知識產權的生物治療相關技術和項目。同時,973計劃也資助了基因治療的基礎研究和應用基礎研究項目,取得了多項重要的研究成果,論文發表在Nature、Science及Cell等*期刊上。
我國基因治療研究及臨床試驗與世界發達國家幾乎同期起步,主要以腫瘤、心血管病等重大疾病為主攻方向。我國已經有2個基因治療產品上市,主要用于頭頸部的惡性腫瘤治療。此外,我國還有近20個針對惡性腫瘤、心血管疾病、遺傳性疾病的基因治療產品進入了臨床試驗,其中在Clinical Trial上登記的基因治療臨床試驗方案有70個,占亞洲基因治療臨床試驗方案總數的46.7%(圖4)。如華中科技大學等研發的腫瘤基因治療產品ADV-TK對肝癌和難治復發性頭頸癌都具有顯著療效,正在開展多中心的Ⅲ期臨床試驗。中山大學等研發的重組人內皮抑素腺病毒注射液(E-10A)治療晚期頭頸鱗癌效果較好,目前該產品在中國和北美地區開展Ⅲ期臨床試驗研究,發展前景好。軍事醫學科學院研發的治療心肌梗塞的基因治療產品Ad-HGF注射液進入II期臨床試驗,與人福醫藥公司合作研發的治療肢端缺血的基因治療產品重組質粒-肝細胞生長因子注射液獲得了Ⅲ期臨床批文。成都康弘生物研發的治療頭頸部腫瘤的工程化溶瘤腺病毒基因治療制劑KH901已完成II期臨床試驗。四川大學等研發的具有抗腫瘤血管生成的基因治療產品EDS01正在開展Ⅱ期臨床試驗研究。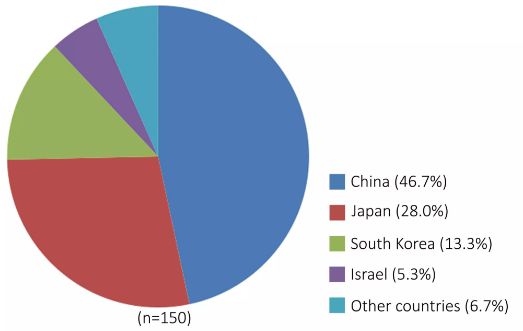
▲ 圖4-亞洲主要國家的基因治療臨床試驗方案分布統計
此外,我國還有40多項重大疾病的基因治療制劑處于臨床前研究階段,上百個項目處于實驗室研究階段。
我國在基因編輯治療領域也處在世界前列。2015年4月,中山大學的黃軍就團隊在人類胚胎細胞中進行了基于CRISPR技術的基因編輯操作,并于2017年9月再次報道利用單堿基編輯系統在人類胚胎基因組修復特定類型的單堿基突變(地中海貧血癥HBB-28)。2016年,四川大學華西醫院在上開展了CRISPR/Cas9基因編輯技術治療肺癌的臨床研究。
雖然基因治療的研究已經取得了較顯著進展,但仍然存在一些安全性及倫理問題,值得進一步研究。臨床試驗應嚴格按照獲得批準的技術規程與標準操作,重視基因治療技術的安全性,充分保障病人知情權,保護病人隱私。盡管基因治療研究還存在很多待解決的技術難題以及一些法律或倫理等方面的問題,但這并不妨礙人們對其治愈重大疾病寄予厚望。