
電話:
021-67610176傳真:
| 導(dǎo)讀 | 小鼠常被用于研究癌癥,但科學(xué)家仍在努力改善這一模型,以更好地研究人類疾病。基因編輯的進(jìn)步使研究人員能夠構(gòu)建更能反映人類疾病的小鼠模型。 |
本文轉(zhuǎn)載自“生命奧秘”。
1915年,處于戰(zhàn)爭狀態(tài),日本病理學(xué)家Katsusaburo Yamagiwa和他的助理Koichi Ichikawa正在努力研究一個(gè)致命武器,其殺傷力堪比西線戰(zhàn)場的戰(zhàn)爭。這個(gè)來自東京大學(xué)(Imperial University)的二人組花了150多天把煤焦油涂在兔子的耳朵上。zui后,他們發(fā)現(xiàn)兔子罹患了腫瘤。
Yamagiwa的兔子模型被認(rèn)為是*個(gè)用于癌癥研究的動(dòng)物模型。自此,科學(xué)家使用了包括細(xì)胞系、基因工程小鼠在內(nèi)的多個(gè)模型來模擬人類癌癥。但為解答特定實(shí)驗(yàn)問題而選擇模型時(shí)需要考慮多個(gè)因素。
據(jù)馬薩諸塞州波士頓丹娜法伯癌癥研究院(Dana-Farber Cancer Institute)的醫(yī)學(xué)腫瘤學(xué)家David Weinstock表示,什么樣的模型是一個(gè)好的癌癥模型“是一個(gè)非常復(fù)雜的問題,zui簡單的答案是它必須能夠給我啟發(fā)——真正回答我想問的問題。如果不能,那就是在浪費(fèi)我的時(shí)間”。
對于美國國家癌癥研究所(US National Cancer Institute, NCI)的部門負(fù)責(zé)人Nancy Boudreau來說,模型與人類癌癥的相似度至關(guān)重要。她表示,模型越能體現(xiàn)人類疾病的發(fā)生和發(fā)展就越好。理想的癌癥模型應(yīng)該能夠反映人類癌癥發(fā)生的許多特征,包括如何應(yīng)對免疫系統(tǒng)、如何轉(zhuǎn)移,或從其主要來源擴(kuò)散到身體的其它部位,以及如何對治療產(chǎn)生響應(yīng)。這需要科學(xué)家了解每種癌癥模型的優(yōu)缺點(diǎn),因?yàn)闆]有哪個(gè)模型能夠解答所有問題。
一些證據(jù)表明,盡管有很多選擇,但現(xiàn)有的癌癥模型還不足以開發(fā)療法。生物技術(shù)創(chuàng)新組織(Biotechnology Innovation Organization)審查了從2006年至2015年的臨床試驗(yàn),結(jié)果發(fā)現(xiàn),在針對15種疾病組別的臨床試驗(yàn)中,癌癥藥物的失敗率zui高,在通過臨床1期的癌癥藥物中,zui終獲得批準(zhǔn)的比例僅為5.1%。相比之下,血液學(xué)和傳染病藥物的臨床試驗(yàn)成功率分別為26.1%和19.1%。
德國癌癥研究中心(German Cancer Research Center)的血管腫瘤專家Hellmut Augustin指出,如果更好的臨床前模型可以將臨床轉(zhuǎn)化率提高10%,這將極大地提高臨床前癌癥研究的質(zhì)量,并為藥物節(jié)省巨大開支。
研究人員一直為改進(jìn)現(xiàn)有模型做出了諸多努力。他們在范圍內(nèi)展開合作,希望改善這些模型。例如,NCI、英國癌癥研究所(Cancer Research UK)、英國維康信托桑格研究所(Wellcome Trust Sanger Institute)和荷蘭烏得勒支的非營利性組織Hubrecht Organoid技術(shù)公司聯(lián)手開展了一項(xiàng)名為人類癌癥模型倡議(Human Cancer Models Initiative)的計(jì)劃。該倡議于2016年啟動(dòng),目標(biāo)是在細(xì)胞系中開發(fā)1000種新型癌癥模型,以供研究人員使用。這些項(xiàng)目表明,許多科學(xué)家都認(rèn)同擴(kuò)大癌癥模型庫的價(jià)值。
修飾小鼠基因組
一般情況下,細(xì)胞株都可以幫助我們解決很多研究難題。但這些細(xì)胞通常以2D形式生長,缺乏人類癌癥生長,尤其是免疫系統(tǒng)生長的正常條件。這使培養(yǎng)的細(xì)胞不適合模擬癌癥的多個(gè)特征。NCI的癌癥系統(tǒng)生物學(xué)家Shannon Hughes指出,相比之下,基因工程小鼠(genetically engineered mouse, GEM)適用于多個(gè)研究。它們能更好地模擬人類癌癥特征,并且容易操控。
多年來,基因工程小鼠需要復(fù)雜的過程來產(chǎn)生所需的DNA,在培養(yǎng)基中轉(zhuǎn)化細(xì)胞,然后將其注入到小鼠胚胎,以修飾小鼠的基因。但是,與大多數(shù)其它遺傳修飾應(yīng)用一樣,現(xiàn)在制作GEM的方法隨著CRISPR基因編輯系統(tǒng)的問世而獲得改進(jìn)。紐約威爾康奈爾醫(yī)學(xué)院(Weill Cornell Medical College)的癌癥生物學(xué)家Lukas Dow表示,CRISPR可以完成一些非常精細(xì)的、以前無法完成的操作。例如現(xiàn)在誘導(dǎo)大型染色體重組,如反轉(zhuǎn)、缺失和易位的技術(shù)已經(jīng)比較簡單直接了。但有了CRISPR后,科學(xué)家甚至可以改變嚙齒動(dòng)物的DNA中的一個(gè)堿基。他指出,這種技術(shù)還可以清晰到讓每個(gè)堿基的分辨率準(zhǔn)確再現(xiàn)科學(xué)家在人類癌癥中觀察到的突變。以前的癌癥模型都忽略了這些細(xì)節(jié),但是病因往往就在這些細(xì)節(jié)里。
韓國基礎(chǔ)科學(xué)研究所(South Korea’s Institute for Basic Science)的基因組工程師Taeyoung Koo等人使用CRISPR靶向一個(gè)非小細(xì)胞肺癌(non-small-cell lung cancer, NSCLC)突變。他們報(bào)告指出,15%的人類NSCLC病例涉及表皮生長因子受體(epidermal growth-factor receptor, EGFR)基因中僅一個(gè)DNA堿基的改變(即單核苷酸突變)。目前治療方案主要是使用靶向該基因的突變蛋白的藥物,例如gefitinib。
Koo的團(tuán)隊(duì)開發(fā)了CRISPR-Cas9向?qū)NA序列,該序列識別zui常見的EGFR突變區(qū)域(這種突變占EGFR突變相關(guān)NSCLC病例的40%以上)。然后他們將人類NSCLC腫瘤植入小鼠,并用CRISPR-Cas9和特定的向?qū)NA靶向突變。結(jié)果顯示,設(shè)計(jì)合理的向?qū)NA能準(zhǔn)確地打斷致病序列,產(chǎn)生治療效果。他們報(bào)告稱,Cas9酶可以有效區(qū)分EGFR突變型等位基因與野生型等位基因,從而破壞致癌基因,誘發(fā)癌細(xì)胞死亡。
Dow提醒,雖然CRISPR具有顯著的靶特異性,但其切割結(jié)果高度多變。因此,如果目標(biāo)是在所有病例中都產(chǎn)生一致的遺傳變化,那么Cas9之類的核酸酶就不是一個(gè)好選擇了。傳統(tǒng)CRISPR系統(tǒng)中DNA修復(fù)的隨機(jī)性意味著,你需要面對細(xì)胞異質(zhì)性的問題。
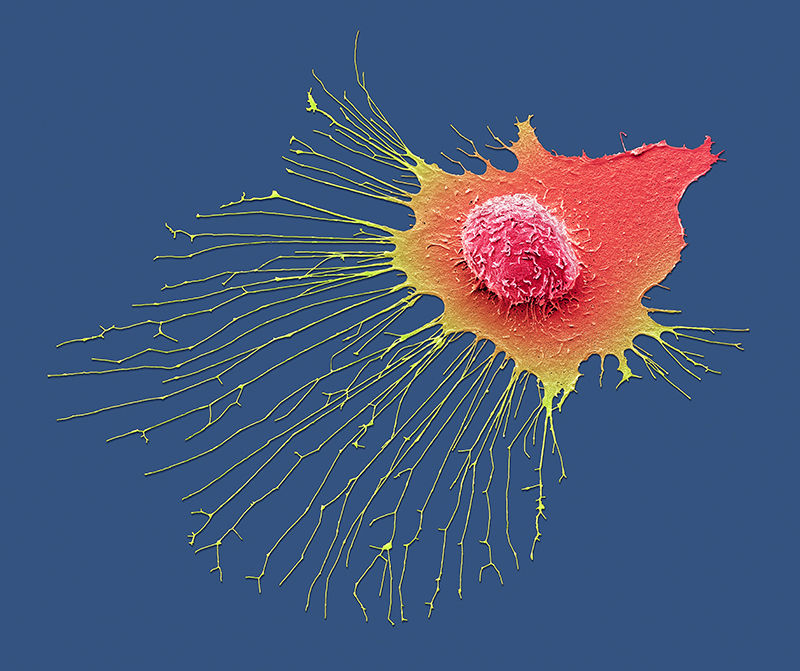
一個(gè)乳腺癌細(xì)胞在顯微鏡下遷移。
GEM有其局限性,特別是在疾病的發(fā)展時(shí)間和異質(zhì)性方面。據(jù)Hughes解釋,小鼠腫瘤發(fā)展非常快,從而迫使研究人員加快他們的實(shí)驗(yàn)進(jìn)度,但這與人類疾病的發(fā)展速度大不相同。此外,小鼠腫瘤往往過于同質(zhì),而無法正確反映人類疾病:GEM通常只包含一兩個(gè)基因改變,而人類腫瘤通常有很多基因改變。
為了解決缺乏異質(zhì)性的問題,并產(chǎn)生更忠實(shí)于人類癌癥的模型,德州大學(xué)安德森癌癥中心(University of Texas MD Anderson Cancer Center)的生物醫(yī)學(xué)科學(xué)家Lorenzo Federico等人在系統(tǒng)生物學(xué)家Gordon Mills的實(shí)驗(yàn)室里展開研究,設(shè)計(jì)了一系列來自轉(zhuǎn)基因小鼠原發(fā)乳腺腫瘤的可移植細(xì)胞系。zui后他們得到了12個(gè)新的小鼠移植細(xì)胞系——可以可靠地產(chǎn)生具有一系列突變的特定類型的腫瘤小鼠模型。Federico表示,理想的情況是,不同小鼠發(fā)生的不同原發(fā)性腫瘤應(yīng)具有不同的分子改變,以更忠實(shí)地反映人類癌癥的遺傳特征。
這些模型已被用于靶向治療(包括癌癥分子途徑抑制劑)的臨床前評估。根據(jù)Federico的說法,這些模型也非常適合研究免疫系統(tǒng)在腫瘤發(fā)生和治療發(fā)展中的作用。然而,他指出,由于這些移植物來源于基因工程小鼠腫瘤,對于得到的結(jié)果,“我們需要保持謹(jǐn)慎”。
癌癥如何發(fā)生和發(fā)展,取決于它與宿主免疫系統(tǒng)的相互作用。其中一些zui有希望的治療方法是免疫療法,它通過激活患者的免疫系統(tǒng)來攻擊特定的腫瘤。為了研究這些療法,科學(xué)家需要具有完整免疫系統(tǒng)的小鼠——是具有人類的免疫系統(tǒng)。這就需要人源化的小鼠模型。
為了讓GEM擁有人的免疫系統(tǒng),科學(xué)家要將人造血干細(xì)胞(多種血細(xì)胞的前體細(xì)胞)植入免疫缺陷的小鼠體內(nèi)。這一過程重現(xiàn)了人體免疫系統(tǒng)的某些方面,例如負(fù)責(zé)攻擊外來細(xì)胞的白血球。然后,研究人員便可以將人類腫瘤樣本(病人源性腫瘤異種移植物,patient-derived xenograft, PDX)移植到小鼠體內(nèi),創(chuàng)建更真實(shí)的人類疾病模型。
根據(jù)Augustin的說法,PDX模型越來越受到藥物的歡迎。藥物開發(fā)商將PDX用作藥物測試的試驗(yàn)基地。PDX模型也開始進(jìn)入基礎(chǔ)研究實(shí)驗(yàn)室,并且可以在市場上購買到。緬因州巴爾港的杰克遜實(shí)驗(yàn)室(Jackson Laboratory)與超過20家癌癥診所合作,創(chuàng)建了450多種這類小鼠模型,其中包括急性骨髓性白血病和膀胱癌、乳腺癌、肺癌、卵巢癌和胰腺癌。Jackson實(shí)驗(yàn)室表示,這些小鼠的成本通常是標(biāo)準(zhǔn)免疫缺陷小鼠的三倍。
科學(xué)家也可以開發(fā)自己的PDX小鼠模型。圣裘德兒童研究醫(yī)院(St. Jude Children’s Research Hospital)的腫瘤學(xué)家Elizabeth Stewart等人使用手術(shù)切除的、能反映大腦、骨骼和其它癌癥的小兒實(shí)體瘤樣本,構(gòu)建了67個(gè)PDX小鼠模型,這覆蓋了十多種腫瘤類型。
Stewart等人的目標(biāo)是創(chuàng)建模型來研究針對不同腫瘤類型的藥物的治療效果——這需要模型準(zhǔn)確地代表原始疾病。Stewart的研究小組決定使用全基因組和全外顯子DNA測序技術(shù),從核酸水平上比較PDX和原始腫瘤。他們發(fā)現(xiàn),總體而言,PDX的DNA序列在很大程度上與原始腫瘤的基因組特征相匹配,但也出現(xiàn)了新的突變。據(jù)研究人員總結(jié),PDX“保留了患者腫瘤的分子和細(xì)胞特征,以及其發(fā)育起源的表觀遺傳特征”。
這并不是說PDX是靜態(tài)的。哈佛-MIT博德研究所(Broad Institute of Harvard and MIT)的所長Todd Golub及其研究小組研究了代表24種癌癥的543個(gè)PDX模型中的拷貝數(shù)變異(copy-number variations, CNV)。他們發(fā)現(xiàn), 原始小鼠1次傳代后,60%的PDX中插入了長達(dá)500萬個(gè)堿基的CNV基因擴(kuò)增區(qū)域,4次傳代后這個(gè)概率是88%。結(jié)果顯示,zui初模仿人類疾病的PDX可以演變成不能模仿人類疾病的形式。當(dāng)這種情況發(fā)生時(shí),PDX便不能再模擬目標(biāo)癌癥了。
Boudreau認(rèn)為,將人類PDX模型組織移植到人源化小鼠中會得到zui有吸引力的一種新癌癥模型,但他表示這“尚未*實(shí)現(xiàn)”,因?yàn)檠芯咳藛T尚未掌握技術(shù)的細(xì)節(jié)。據(jù)她補(bǔ)充,隨著科學(xué)家對免疫治療和腫瘤響應(yīng)的機(jī)制的興趣的增加,人源化小鼠將會變得非常重要。
回歸原始方法
一些科學(xué)家使用Yamagiwa的老方法,而不是基因技術(shù)來制造更實(shí)用的癌癥模型。這種化學(xué)致癌方法以普通的實(shí)驗(yàn)室小鼠為研究對象,結(jié)果可以產(chǎn)生更真實(shí)的癌癥模型。
據(jù)加利福尼亞大學(xué)舊金山分校(University of California, San Francisco)的腫瘤生物學(xué)家Melissa Reeves解釋,用一種致癌物質(zhì)處理小鼠,就像一種環(huán)境因素會造成特定類型的損傷,并獲得特定類型的腫瘤,如皮膚腫瘤。這對于模擬由于重復(fù)暴露于特定環(huán)境的人類腫瘤很有幫助,因?yàn)樗M了由廣泛基因損傷引起的腫瘤的自然演變。
化學(xué)致癌物質(zhì)可能會在數(shù)百個(gè)位點(diǎn)破壞DNA,并且隨著時(shí)間的推移影響會繼續(xù)存在。Reeves等人采用這種方法,在小鼠皮膚局部涂抹名為DMBA和TPA的已知致癌物,誘導(dǎo)小鼠發(fā)生皮膚癌,進(jìn)而研究腫瘤如何從原發(fā)部位轉(zhuǎn)移至繼發(fā)部位。她的研究結(jié)果表明,皮膚癌不會按順序從一個(gè)位置遷移到另一個(gè)位置——例如,從皮膚到淋巴結(jié)再到肺,而是“通過平行傳播,同時(shí)進(jìn)入淋巴結(jié)和肺部”。
Reeves表示,這一成果證實(shí)了一個(gè)臨床發(fā)現(xiàn):去除乳腺癌周圍的淋巴結(jié)并不總是能夠提高生存率,這一觀察結(jié)果促使研究人員推測平行傳播的可能性。
盡管與GEM和人源化小鼠相比,化學(xué)致癌作用可能可以產(chǎn)生更好的、類似于人類癌癥異質(zhì)性的腫瘤,但實(shí)際上這些模型也存在明顯的缺點(diǎn)。通過化學(xué)手段誘發(fā)原發(fā)性腫瘤,然后將其移除并研究轉(zhuǎn)移過程,可能需要18個(gè)月。Reeves指出,另外,每個(gè)腫瘤都會有所不同。
同樣,每種癌癥模型都不盡相同,小鼠模型并不總是的選擇,小鼠的飼養(yǎng)費(fèi)用昂貴,并容易引起倫理問題,這讓細(xì)胞系不失為一種值得考慮的研究對象。
目前,研究人員只能選擇一種zui能解答他們問題的模型——盡管存在缺陷。同時(shí),科學(xué)家將不斷改善現(xiàn)有模型,并開發(fā)新模型。正如Augustin指出的那樣,“用于開發(fā)和使用臨床轉(zhuǎn)化率更高的小鼠腫瘤模型的投資非常有意義。”否則,我們可能永遠(yuǎn)無法提高臨床試驗(yàn)中癌癥藥物的成功率。
小鼠并不是研究人員模擬癌癥的*選擇。一種流行的新興替代方法是類器官——模仿一些器官的微觀解剖,例如血管系統(tǒng)的3D細(xì)胞培養(yǎng)物。
法國奧爾良分子生物物理中心(Centre for Molecular Biophysics)的分子生物學(xué)家Claudine Kieda表示,腫瘤就像是一個(gè)多種組織合作的器官。3D細(xì)胞模型可充分考慮微環(huán)境,例如腫瘤周圍和內(nèi)部的氧氣水平。
Kieda的實(shí)驗(yàn)室將黑素瘤和內(nèi)皮細(xì)胞結(jié)合在由膠原蛋白、生長因子和一個(gè)名為Matrigel的3D支架組成的基質(zhì)中。這種混合物允許細(xì)胞形成類似于腫瘤及其周圍環(huán)境,特別是在氧化方面的結(jié)構(gòu)。Kieda指出,每個(gè)細(xì)胞都在像孵化器那樣的環(huán)境中工作,氧氣的分壓遠(yuǎn)遠(yuǎn)高于體內(nèi)。”
此外,類器官對于藥物開發(fā)也很有價(jià)值。例如,英國劍橋大學(xué)(University of Cambridge)的組織修復(fù)生物學(xué)家Meritxell Huch等人創(chuàng)建了用于藥物篩選的肝癌類器官。這種類型的腫瘤只有20%的概率能在小鼠身上生長,但Huch實(shí)現(xiàn)了近80%的成功率——并且該過程的效率大約是PDX的兩倍。Huch表示,速度是主要優(yōu)勢。Huch的研究小組利用這些類器官,開發(fā)了一種信號通路抑制劑,以用于治療原發(fā)性肝癌。
與其它癌癥模型一樣,一個(gè)好的類器官要盡可能地忠實(shí)地重現(xiàn)人類疾病。美國國家癌癥研究所(US National Cancer Institute)的腫瘤轉(zhuǎn)移研究員Nancy Boudreau表示,類器官比細(xì)胞更具生物學(xué)特性,而且比小鼠便宜。
原文檢索:
Mike May. (2018) Cancer research with a human touch. Nature, 556: 259-261.