
電話:
021-67610176傳真:
在一項新的研究中,在美國羅莎琳德-富蘭克林大學的David M. Mueller領導下,一個研究團隊解析出線粒體ATP合酶(ATP synthase)結構,其中這種酶是一種制造ATP的酶,而ATP是細胞的主要能源。相關研究結果于2018年4月12日在線發表在Science期刊上,論文標題為“High-resolution cryo-EM analysis of the yeast ATP synthase in a lipid membrane”。
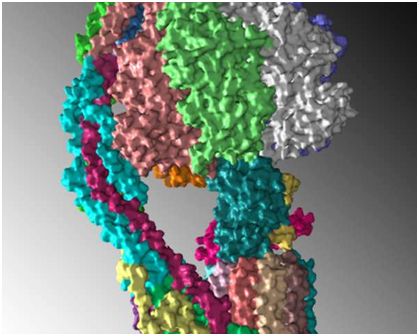
圖片來自Rosalind Franklin University。
鑒于ATP合酶在給細胞提供能量中的重要性,確定這種酶的完整結構一直是這個科學領域的zui高目標,這是因為這有望揭示這種酶的秘密,從而可能導致人們鑒定出治療靶點,并加速對代謝疾病和其他細胞病變的理解。
Mueller說,“理解這種酶如何發揮作用需要了解它在原子水平上的三維分子結構。”他和他的合作者們利用低溫電鏡技術解析出這種酶在近原子分辨率下的結構。
ATP合酶的*完整結構為藥物寡霉素(oligomycin)抑制這種酶的機制和致病性突變如何破壞這種酶的功能提供證據。解析出這種酶的結構就為理解在疾病和藥物作用機制中可能發揮的更加廣泛的功能克服了障礙。
這項研究為確定ATP合酶的其他功能狀態的結構鋪平道路,其中這種酶已成為實驗室數十年結構研究的課題。
Mueller和他的合作者們采取了一種不同的方法。他們利用低溫電鏡技術來破譯這種工程ATP合酶,其中這種工程ATP合酶由酵母合成,并讓它重組到納米盤中,用于結構分析。盡管低溫電鏡技術并不是新技術,但是技術上的進步使得在近原子分辨率下解析出它的結構稱為可能。(生物谷 Bioon.com)
參考資料:
Anurag P. Srivastava1,*, Min Luo2,*, Wenchang Zhou et al. High-resolution cryo-EM analysis of the yeast ATP synthase in a lipid membrane. Science, Published online:12 Apr 2018, doi:10.1126/science.aas9699