
電話:
021-67610176傳真:
LC-MS的強大功能已經得到了生物醫學實驗室的認可。1,2現在的LC-MS儀器已經從研究到常規臨床實驗室范圍廣泛使用,并有效應用于以下領域:
· 治療藥物監測 - 測量血漿,血液或組織中的藥物(例如免疫抑制劑)
· 濫用藥物測試 - 測量在尿液或唾液中的藥物
· 激素測試 - 測量血清或血漿中的激素(例如類固醇或甲狀腺激素)
· 生物胺分析 - 測量血漿或尿液中的生物胺(如兒茶酚胺)
· 新生兒篩查 - 通過使用LC-MS水平監測氨基酸和酰基肉堿檢測嬰兒可治療的疾病
LC-MS儀器相對于其他分析工具具有很強的吸引力,原因在于該技術能夠以非常高的靈敏度同時測量多種復雜分析物。此外,速度和信任也是患者護理的關鍵因素,同時成功的LC-MS生物醫學分析具有高度靈敏度,可追溯性強和數據可靠的特性。因此,對于生物醫學用LC-MS工作流程中的試劑水及其水在LC-MS成功分析實踐中的作用將通過以下三個方面進行介紹。
靈敏度
超純水被廣泛用于LC-MS流程的各個環節(圖1),所以是導致實驗數據鬼峰,基線噪音和高MS背景等這些原因的主要污染源。同時也會使儀器或方法的靈敏度下降,使一些低濃度分析變的困難3。為了避免干擾,確保檢測到的分析物是來自樣品,而非來自實驗用水4,實驗過程需要使用高質量的超純水,避免數據偏差和再次污染5。

Figure 1. The role of water in the LC-MS laboratory
超痕量分析是LC-MS生物醫學分析中的一個應用領域,在激素檢測中,相較于其他實驗成分,其中水的使用量是非常大的。因此將Milli-Q水(電阻率18.2MΩ·cm(25℃),TOC<5ppb)作為激素中雌二醇分析的實例進行分析。這個實驗的結果如圖2所示,其中MRM色譜圖顯示Milli-Q®水中不存在雌二醇,確保了分析方法的低檢出限,使用標準加入法測得雌二醇濃度為265.40ng/L。
前體離子273m/z和碎片離子255m/z用多反應監測(MRM)ESI+轉換。HPLC和MS以及LC-MS/MS的儀器參數以及制備Milli-Q®水所用水源,見圖2。
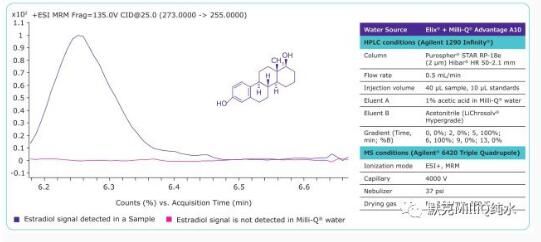
Figure 2. MRM chromatogram (ESI+) of estradiol in a sample and in Milli-Q®water.
可追溯性
水純化系統的在線監測功能使科學家們確定他們所使用的水是否符合LC-MS分析的要求。但是,當問題產生時,說明LC-MS分析過程中已經出現了污染,找到并消除其來源至關重要,因為污染隱患來源非常多,使用LC-MS實驗時收集記錄的水質參數的數據可以在特定的日期與污染源聯系起來,從而促進水質評估和問題的排查。
而且,在所有臨床實驗室中,可追溯性都是質量管理體系中的重要需求,能使實驗室符合認證,例如,ISO15189:2007標準或CLSI®C3—A4。所以,在這種情況下用電子方式記錄水質參數的方法是一種確保高質量認證的解決方案。
可靠性
為了滿足LC-MS生物醫學實驗室的要求,水源必須可靠。所以水純化系統不僅要生產高質量的實驗用水,而且這個質量必須始終如一。為確保水質的一致性,使用在線監測工具。水中的離子含量通過電阻率測量來評估,通常電阻率18.2MΩ·cm(25℃)的水表示不含離子雜質。
為了檢測有機污染物程度,可用可氧化總有機碳(TOC)計算;TOC低于5ppb的水(或μg/L)適用于LC-MS實驗。因此,要檢測水質的穩定性需要連續監測Milli-Q®水質的電阻率和TOC參數。圖3顯示了Milli-Q®系統提供的水質穩定性在線監測數據。
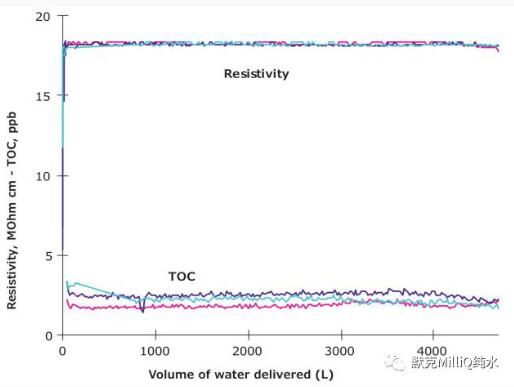
Figure 3. Levels of Resistivity (MOhm·cm) measured continuously and TOC (ppb) measured every 3 minutes as a function of volume produced by a Milli-Q® water system. Di?erent colors refer to data obtained for three di?erent sets of consumables installed by turns.
結論
超純水適用并符合LC-MS生物醫學分析實驗的要求,而且良好的水質對實驗的高質量和穩定性至關重要。臨床實驗室LC-MS實驗 可以使用Milli-Q®水凈化系統即能符合LC-MS儀器高靈敏度的要求還可以獲得可靠和可追溯的分析結果。
References
1. K. S-Y. Leung, B. M-W. Fong, LC–MS/MS in the routine clinical laboratory: has its time come? Analytical and Bioanalytical Chemistry, 406, 2289-2301 (2013).
2. M. Himmelsbach, 10 years of MS instrumental developments--impact on LC-MS/MS in clinical chemistry, J. Chromatogr. B, 883– 884, 3– 17 (2012).
3. A. Khvataeva-Domanov, S. Mabic, Four Ways to Better Water Quality in LC-MS, R&D Magazine, (2015);
4. CLSI®C62-A - Liquid-Chromatography-Mass Spectrometry methods; approved guideline, Johns Hopkins Medical Institutions, First Edition, 5.3.1, 34, (2014)
5. Controlling Contamination in UltraPerformance LC?/MS and HPLC/MS Systems, Waters Corporation;
6. B. Keller, J. Sui, A.B. Young, R.M. Whittal, Interferences and contaminants encountered in modern mass spectrometry, Anal. Chim. Acta, 627, 71-81 (2008).
7. M. Vogeser, C. Seger, Pitfalls associated with the use of liquid chromatography-tandem mass spectrometry in the clinical laboratory, Clin. Chem. 56, 1234-1244 (2010).
8. Millitrack? e-Solutions, A unique set of data management and monitoring software solutions for water purification systems, MilliporeSigma;